Il calorimetro è una scatola all’interno della quale c’è una sostanza, ad esempio acqua. Le pareti della scatola sono fatte in modo tale che il calore non può entrare e non può uscire dalla scatola.
Un termometro ci indica la temperatura a cui si trova l’acqua. Immergendo nell’acqua del calorimetro un corpo che ha una temperatura inizialmente diversa, si osserverà il termometro segnare valori di temperatura variabili fino a raggiungere un nuovo valore di temperatura da cui non si sposta.
Questo significa che acqua del calorimetro e corpo immerso in essa si sono scambiati calore e hanno raggiunto la stessa temperatura.
Se il corpo aveva una temperatura maggiore di quella dell’acqua del calorimetro, il corpo ha ceduto calore all’acqua e la nuova temperatura segnata dal termometro sarà maggiore di quella iniziale dell’acqua e minore della temperatura iniziale del corpo immerso.
Se il corpo aveva una temperatura minore di quella dell’acqua del calorimetro, l’acqua ha ceduto calore al corpo e la nuova temperatura segnata dal termometro sarà minore di quella iniziale dell’acqua e maggiore della temperatura iniziale del corpo immerso.
Si può calcolare il calore scambiato tra corpo immerso nel calorimetro e acqua del calorimetro ricorrendo al calore specifico, cioè la quantità di calore che bisogna fornire ad 1 kg di una certa sostanza per aumentarne la temperatura di 1 grado.
E’ molto importante iniziare a tener presente che non riusciremo a sapere quanto calore in totale è presente in un corpo, ma soltanto quanto calore passa da un corpo all’altro, se partono da diverse temperature.
Facciamo un esempio. Supponiamo di prendere un pezzo di ferro del peso di 10 grammi, riscaldato fino ad una temperatura di 973°C, e di immergerlo nell’acqua del calorimetro.
La massa dell’acqua contenuta nel calorimetro è 100 grammi.
Osserveremo che la temperatura dell’acqua sale dalla temperatura a cui si trovava, ad esempio 20°C, fino a raggiungere un certo valore di circa 30°C.
Raggiunto questo valore, osserviamo che il termometro resta fisso sui 30°C, pur facendo trascorrere molto tempo.
Avendo osservato che la temperatura dell’acqua del calorimetro è aumentata, concluderemo che l’acqua ha assorbito questo “qualcosa” – che chiamiamo calore.
Diremo anche che questo calore assorbito dall’acqua le è stato ceduto dal pezzo di ferro, che doveva inizialmente trovarsi ad una temperatura più alta di quella iniziale dell’acqua del calorimetro. Infatti, abbiamo riscaldato il pezzo di ferro fino ad una temperatura di 973°C prima di metterlo nell’acqua del calorimetro.
Pezzo di ferro e acqua del calorimetro si trovano entrambe alla temperatura di 30°C segnata dal termometro: hanno raggiunto l’equilibrio termico. Altrimenti continuerebbe a fluire calore e la temperatura dell’acqua del calorimetro continuerebbe a cambiare, invece di restare fissa a 30°C.
Come faccio a conoscere la quantità di calore che è passata dal pezzo di ferro all’acqua?
Posso dire che la quantità di calore Q, ceduta dal pezzo di ferro all’acqua, è data da:
Q=(calore specifico del ferro)x(massa del pezzo di ferro)x(variazione della temperatura del ferro)
Il pezzo di ferro è passato da 973°C a 30°C, quindi la variazione della sua temperatura è stata di 943°C. La massa del ferro è 10 grammi = 0,010 Kg.
Questa quantità di calore ceduta dal ferro è la stessa che viene assorbita dall’acqua. L’acqua, essendo diversa dal ferro, avrà un suo calore specifico. Quindi, anche per l’acqua posso dire che:
Q=(calore specifico dell’acqua)x(massa dell’acqua nel calorimetro)x(variazione della temperatura dell’acqua nel calorimetro).
L’acqua del calorimetro è passata da 20°C a 30°C, quindi la variazione della sua temperatura è stata di 10°C. La massa dell’acqua nel calorimetro è 100 grammi = 0,100 Kg.
Siccome il calore Q ceduto dal ferro deve essere uguale al calore Q assorbito dall’acqua, posso scrivere:
(calore specifico del ferro)x(0,010 kg)x(943°C)=(calore specifico dell’acqua)x(0,100 Kg)x(10°C)
Osserviamo in questa equazione che 10 soli grammi di ferro hanno subito una variazione di temperatura molto superiore (circa 100 volte) rispetto alla variazione di temperatura di 100 grammi di acqua, una quantità 10 volte maggiore.
Questo significa che occorre più calore per aumentare di 1°C la temperatura dell’acqua, di quanto ne occorre per raffreddare (o riscaldare) di 1°C la temperatura del ferro.
IL CALORIMETRO DI MAHLER (BOMBA CALORIMETRICA)
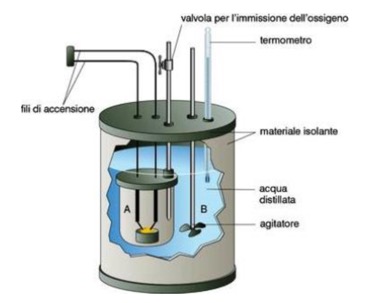
Consiste in un piccolo recipiente di acciaio a pareti robuste, ermeticamente chiuso, in cui è posta una piccola capsula di porcellana contenente la sostanza in esame; nel recipiente vine messo ossigeno puro e la combustione viene innescata mediante una resistenza elettrica a contato con la sostanza.
Facendo passare corrente elettrica nella spirali della resistenza elettrica, questa si arroventa e brucia, provocando la rapida combustione del composto.
Il calore della redazione viene assorbito da una quantità nota di acqua, in cui è immersa la "bomba".
Se la capacità termica C del calorimetro è nota (tenendo conto che il calore specifico dell'acqua è 4,184 J / g x °C), possiamo risalire alla quantità di calore messa in gioco mediante l'espressione: Q = m x 4,184 x (T2 - T1) + C x (T2 - T1)
in cui
m = massa in grammi dell'acqua presente all'interno del calorimetro)
C = capacità termica del calorimetro)
T1 = temperatura iniziale dell'acqua
T2 = temperatura finale dell'acqua
IL CALORIMETRO A GHIACCIO
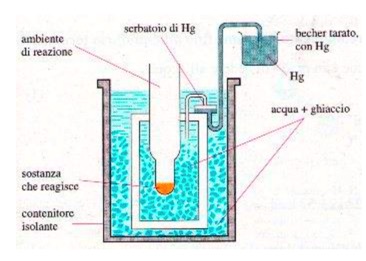
Se la reazione da studiare è esotermica* , il calore svolto fa fondere una parte del ghiaccio attorno all'ambiente di reazione.
La diminuzione di volume crea una depressione nel serbatoio di mercurio, il quale viene aspirato nel becher.
La diminuzione del peso di quest'ultimo permette di risalire al calore di reazione.
Questo tipo di calorimetro si presta a misurare le variazioni termiche delle reazioni che avvengono in soluzione.
* Una reazione chimica che durante il suo svolgimento sviluppa calore è detta "esotermica", mentre una reazione chimica che durante il suo svolgimento assorbe calore dall'esterno è detta "endotermica".
N.B. Siete pregati di segnalare la presenza di link errati o inattivi.
